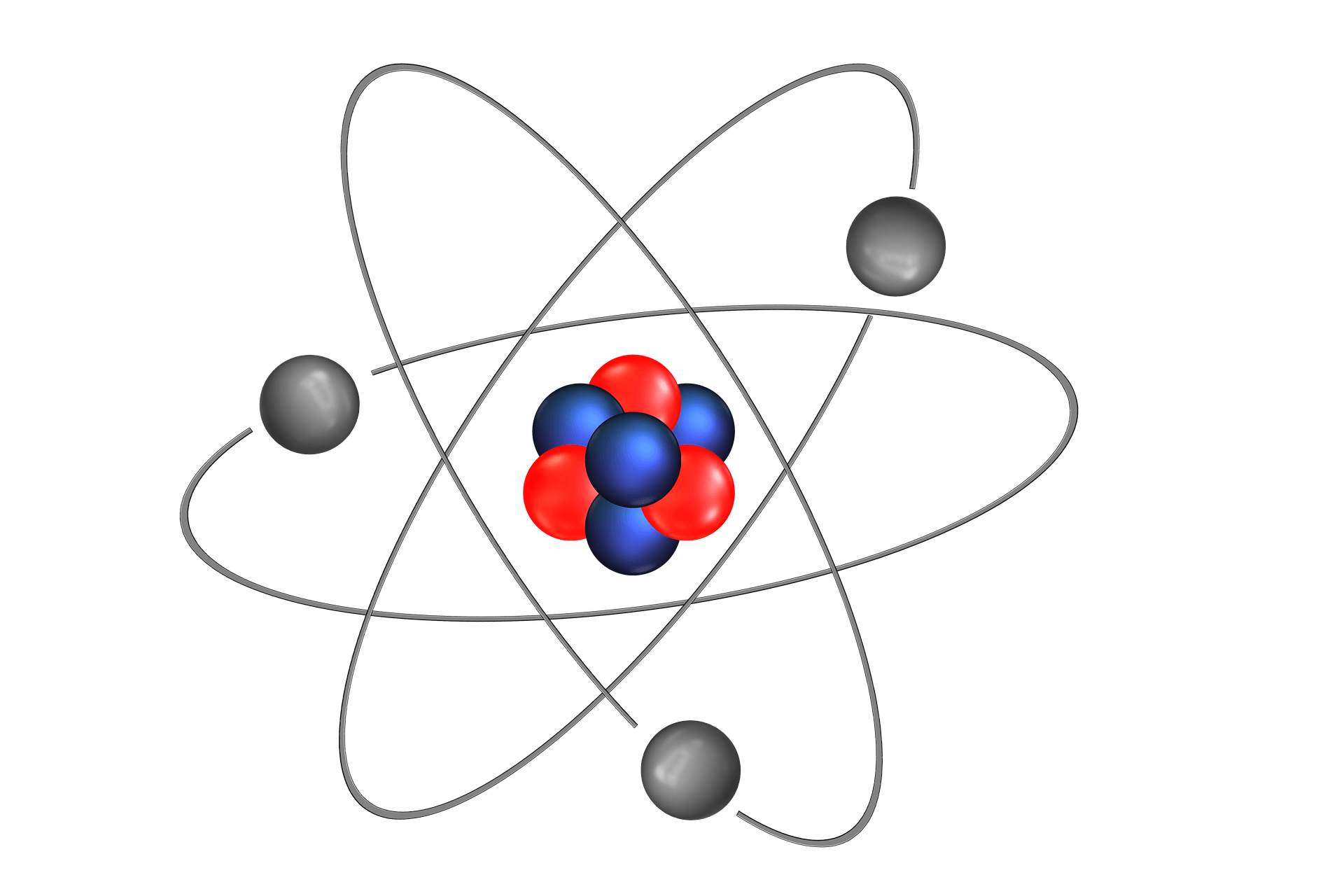
Es normal que cuando pensamos en el átomo se nos venga a la cabeza la idea de un Sistema Solar en miniatura, sin embargo, esta imagen no solo es inexacta, sino que tampoco es físicamente posible. La realidad es más compleja de lo que parece.
Un átomo como el que se ve en la imagen solo puede existir 10-⁸ segundos, en ese tiempo, las «bolitas» terminarían colisionando contra el núcleo. Sí, lo que lees: ¡un átomo como el de la imagen no existiría más allá de una cienmillonésima de segundo!
Sé que te estás preguntando, entonces, ¿cómo se ve el átomo? Pues bien, en realidad resulta ser más complejo de lo que parece…

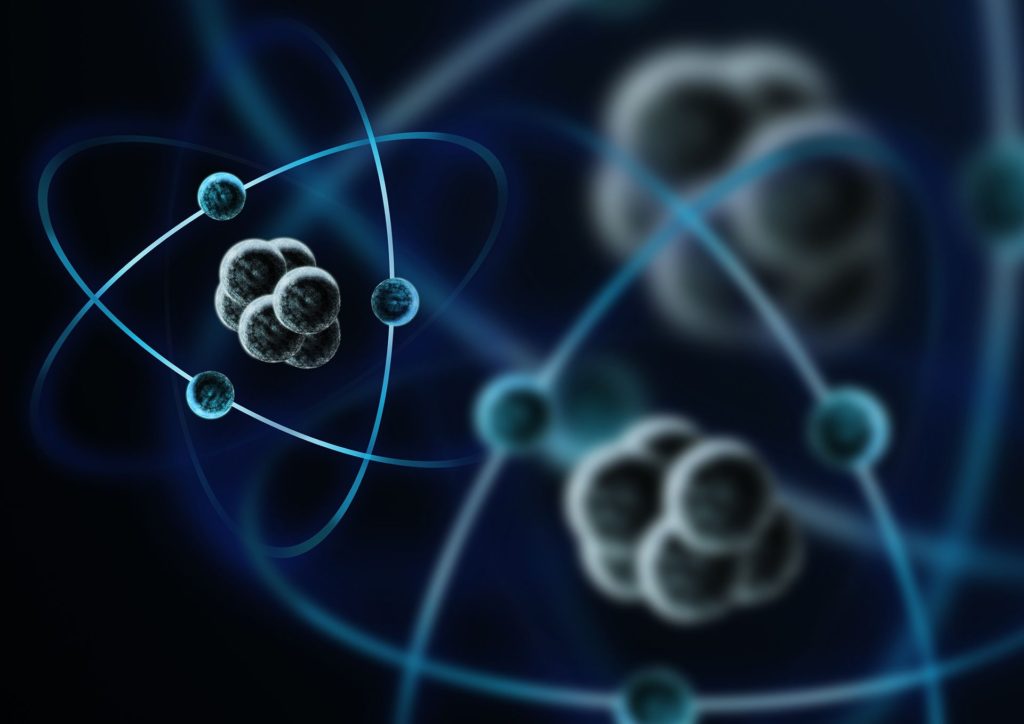
Esta imagen resulta mas realista, porque los electrones pasan de ser entendidos como «bolitas» a nubes de probabilidad. Pese a lo que digo anteriormente, se repite un error similar al ilustrar los neutrones/protones en áreas localizadas, algo que no siempre es así porque estas partículas no están estáticas, sino que se están moviendo constantemente.
Saber la posición exacta de los electrones involucra resolver complejas ecuaciones diferenciales para las cuales no existe solución analítica. Por lo que resulta ser un problema tremendamente complicado para los físicos.
Pero entonces ¿Por qué se enseña el átomo de la primera imagen en las aulas? Probablemente sea porque es más fácil de entender para los niños. Más tomando en cuenta de que los electrones -al representarse como nubes de probabilidad- pueden estar en todos los sitios y a la vez en ninguno. Si, bueno, cosas de la cuántica…